Synthèse de carbonates d'alkylpolyglycosides
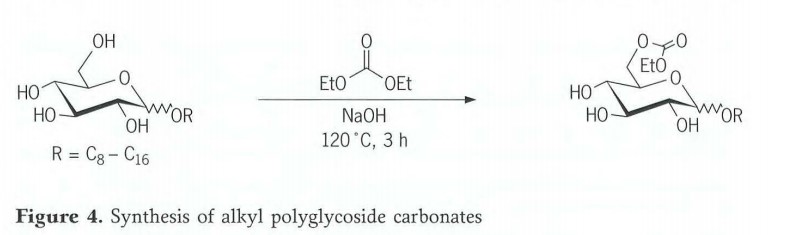
Des carbonates d'alkylpolyglycosides ont été préparés par transestérification d'alkylmonoglycosides avec du carbonate de diéthyle (figure 4). Pour un mélange homogène des réactifs, il s'est avéré avantageux d'utiliser du carbonate de diéthyle en excès, qui sert à la fois de composant de transestérification et de solvant. 2 % molaire d'une solution d'hydroxyde de sodium à 50 % sont ajoutés goutte à goutte à ce mélange sous agitation à environ 120 °C. Après 3 heures de reflux, le mélange réactionnel est refroidi à 80 °C et neutralisé avec de l'acide phosphorique à 85 %. L'excès de carbonate de diéthyle est distillé sous vide. Dans ces conditions réactionnelles, un groupe hydroxyle est de préférence estérifié. Le rapport éduit/produits est de 1:2,5:1 (monoglycoside : monocarbonate : polycarbonate).
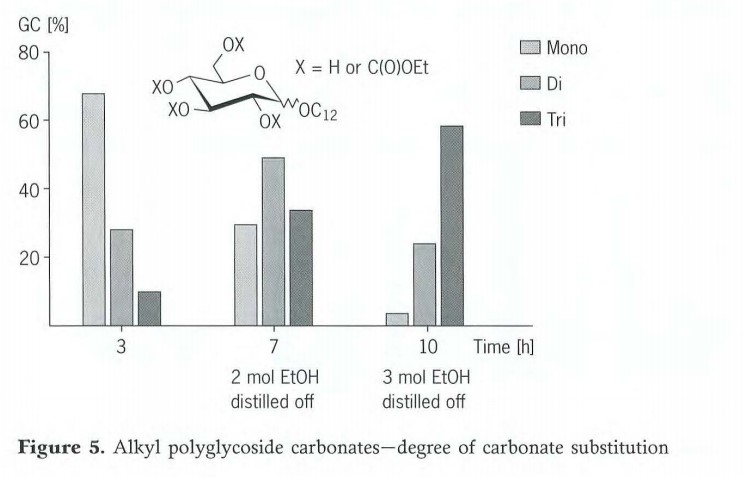
Outre le monocarbonate, cette réaction produit également des produits présentant un degré de substitution relativement élevé. Le degré d'addition de carbonate peut être contrôlé par une gestion habile de la réaction. Pour un C12 Dans le cas du monoglycoside, une distribution de mono-, di- et tricarbonate de 7:3:1 est obtenue dans les conditions réactionnelles décrites ci-dessus (figure 5). Si le temps de réaction est porté à 7 heures et que 2 moles d'éthanol sont distillées pendant ce temps, le produit principal est le C12 Dicarbonate de monoglycoside. Si l'on augmente la réaction à 10 heures et que l'on élimine 3 moles d'éthanol par distillation, le principal produit final obtenu est le tricarbonate. Le degré d'addition de carbonate, et donc l'équilibre hydrophile/lipophile du composé alkylpolyglycoside, peuvent ainsi être facilement ajustés en faisant varier le temps de réaction et le volume du distillat.
Date de publication : 22 mars 2021